多肽因其良好的生物相容性、功能多样化和易于合成修饰等优点,已被广泛用于构建靶向药物传递系统。本文重点介绍了多肽在肿瘤治疗中的应用及研究进展,主要分为肿瘤靶向性多肽和刺激响应型多肽材料两个方面。
1、肿瘤靶向性多肽
1.1被动靶向
利用肿瘤的增强渗透滞留效应(EPR),纳米粒子或大分子物质能够选择性地透过肿瘤血管壁间隙,并长期停留在肿瘤组织中。
1.2主动靶向
通过修饰靶向分子实现对肿瘤细胞的定向运输。常见的靶向基团包括小分子、多肽、核酸适配子和抗体等。其中,多肽靶向具有低免疫反应、低成本和简单易操作等优势。
1.2.1肿瘤细胞靶向肽
如含精氨酸-甘氨酸-天冬氨酸(RGD)序列的多肽,可特异性识别整合素αvβ3受体,广泛应用于肿瘤靶向治疗。
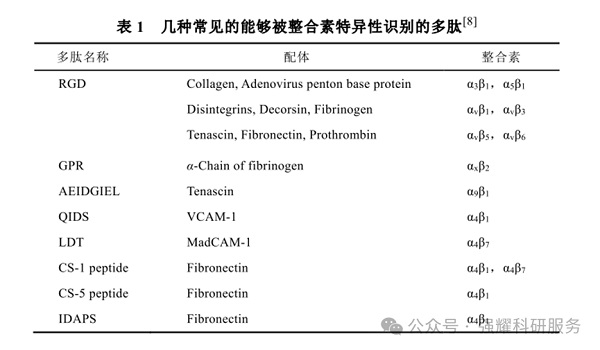
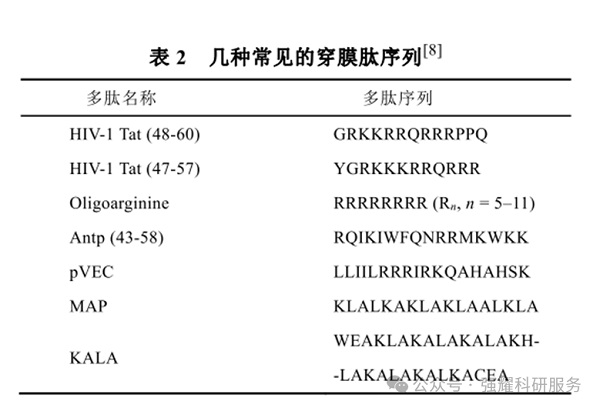
1.2.2.细胞穿膜肽
如HIV-1 Tat多肽,能直接携带活性物质穿透细胞膜,提高药物的细胞内吞效率。
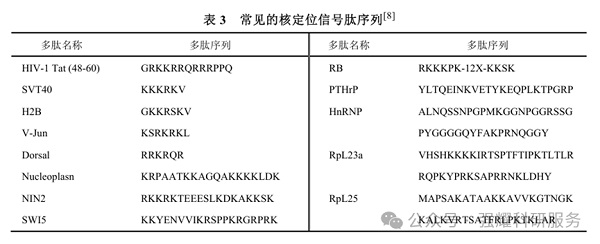
1.2.3.核定位信号肽
短肽序列可将活性物质运输至细胞核,实现细胞核原位光动力学治疗(PDT)。
1.2.4.线粒体靶向肽
如(KLAKLAK)2,可通过阳离子性质靶向线粒体,结合光敏剂实现肿瘤光动力学治疗。
2、刺激响应型多肽材料
多肽材料能够响应肿瘤微环境的特定刺激,实现药物的精准释放。
2.1酶响应型
2.1.1.基质金属蛋白酶(MMPs)响应型
基质金属蛋白酶(MMPs)是一类需要金属离子(如 Ca2+、Zn2+)作为辅助因子的酶家族。 在正常组织中表达量低,但在炎性反应和肿瘤侵袭转移时显著上升。 能降解细胞外基质蛋白,破坏肿瘤侵袭的屏障,在肿瘤侵袭和转移中,MMPs 起关键作用。 可构建基于 MMPs 响应型的多肽诊疗体系。通过设计对MMPs敏感的多肽序列,如GPLGIAGQ,实现PEG外壳脱落和细胞穿膜肽暴露。
2.2.2.凋亡酶响应型
凋亡酶(Caspases)是结构相关的半胱氨酸蛋白酶,活性位点含半胱氨酸。 它们能特异性断开天冬氨酸残基后的肽键,在细胞程序性死亡(凋亡)中起关键作用。 临床上化疗、放疗等通过诱导细胞凋亡抑制肿瘤生长。因此 Caspases 可用于评价肿瘤治疗效果。 不同 Caspases 特异性识别不同的多肽序列。 如Caspase-3可特异性切断DEVD多肽序列,释放药物或荧光探针,评估肿瘤治疗效果。
2.2.3.组织蛋白酶响应型
半胱氨酸组织蛋白酶属于溶酶体蛋白酶,主要存在于细胞内。 在早期肿瘤组织中会特异性高表达。 组织蛋白酶 B 可水解多种多肽,在肿瘤间质中过度表达。 20 世纪 80 年代发现 GFLG 序列可被组织蛋白酶 B 水解。被用于酶敏感聚合物前药研究 Yang 等利用含 GFLG 的引发剂合成两亲性聚合物前药。该前药可在组织蛋白酶 B 作用下释放药物。
2.2 pH响应型
相较于正常组织间隙呈偏碱性(pH 7.4 左右), 肿瘤组织因高糖酵解供能和二氧化碳浓度呈偏酸性(pH 6.0–7.0)。 基于此科研人员利用肿瘤微环境的酸性特征,设计酸响应性键或两性离子寡肽脂质体,实现材料在肿瘤环境下的电荷转变,构建 pH 响应型药物体系。
2.3氧化还原响应型
谷胱甘肽(GSH)是含 γ-酰胺键和巯基的三肽,存在于几乎每个细胞。而在肿瘤细胞内的浓度比正常细胞高 4–7 倍,在血浆中浓度很低。 双硫键(―S―S―)可被 GSH 切断,用于控制药物释放。
Chen 等用双硫键连接穿膜肽和凋亡肽,合成聚多肽 xPolyR8-KLA(TPP)。 可同时运载凋亡肽和 p53 基因进入细胞。 进入细胞后,双硫键在高谷胱甘肽(GSH)浓度环境下断裂,释放凋亡肽和 p53,诱导细胞凋亡。
3、结论
多肽作为功能性生物材料,在肿瘤诊断与治疗中展现出巨大潜力。通过整合传统纳米材料和多肽的功能特性,可以开发出具备特异性肿瘤靶向性、优异的选择性和精确药物释放能力的多功能系统。这些基于多肽的纳米材料将极大促进抗肿瘤研究的发展,并推动从基础研究到临床应用的转化。未来,功能型多肽有望在生物医学领域得到更广泛的应用。


 联系我们
联系我们
 返回
返回